현재까지 확인된 희귀질환은 약 7,000여 종 이상이지만 이 중 치료제가 있는 것은 단 5% 정도에 불과합니다. 희귀질환 치료제는 지금까지 의학적 효용이나 경제적 문제, 임상을 위한 환자군 모집의 어려움 등 여러 문제로 더디게 개발되었으나, 이에 변화를 주기 위해 1983년 미국 정부는 Orphan Druct Act(ODA)라는 법안을 발효시켜 희귀질환 치료제 개발에 다양한 혜택을 제공하기 시작했습니다. 2022년 9월 기준으로 희귀질환 치료제로 FDA에 등재된 약물은 총 6,421건에 달할 만큼 현재는 희귀질환 치료제 개발이 매우 활발하게 진행되고 있습니다.
희귀질환 치료제 개발은 희귀질환 환자에게 치료의 기회를 제공한다는 사회적 의미도 있지만, 높은 수익을 가져다 주기도 합니다. ODA 등의 규제 지원으로 인해 신약 개발 비용은 세제 혜택 등으로 비교적 저렴한데 반해 값은 비싸고 치료에 대한 독점권을 얻을 가능성이 높습니다. 의약품 시장조사 기관인 이벨류에이트 파마에 따르면 희귀질환 치료제는 개발 착수부터 임상 2상까지 걸리는 기간이 평균 3.9년으로, 일반 치료제에 비해 1.5년 가량 짧습니다. 또한 시장 성공률은 11.3%로 측정되는데 이는 일반 치료제의 성장률(5.3%)보다 월등히 높은 수치입니다.
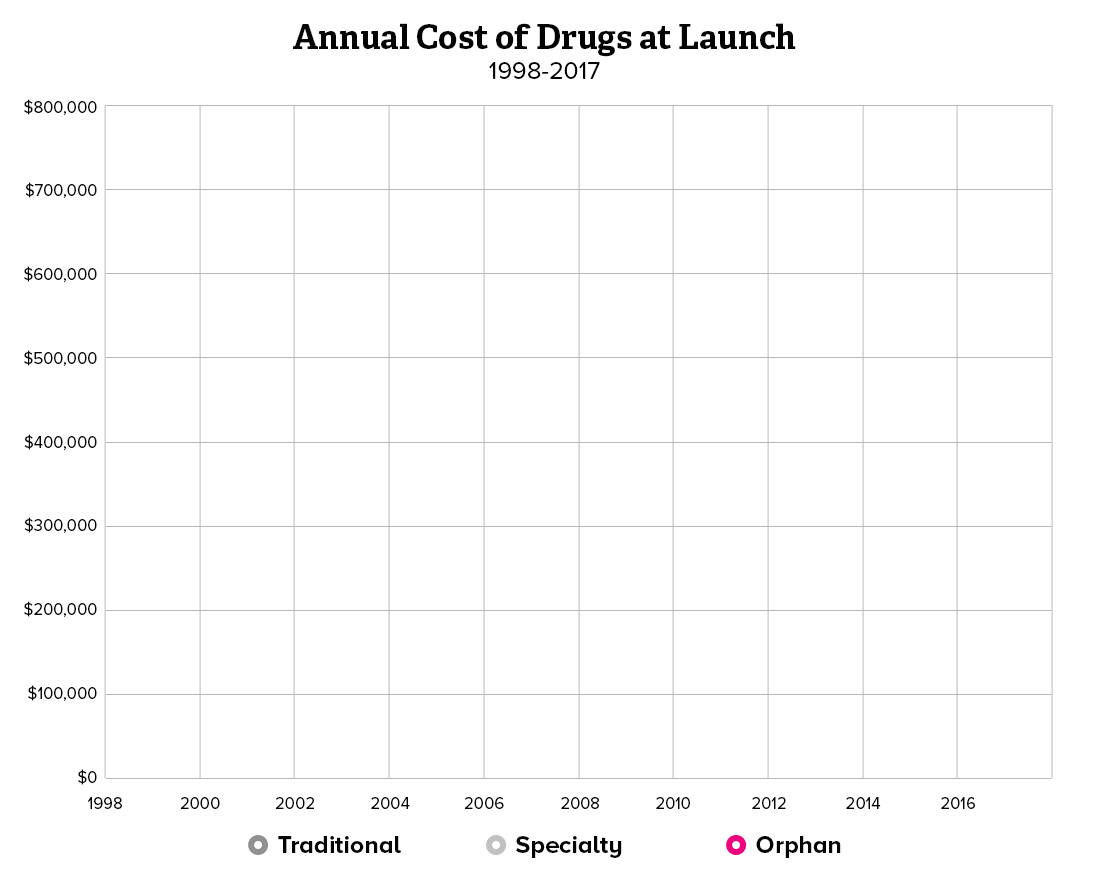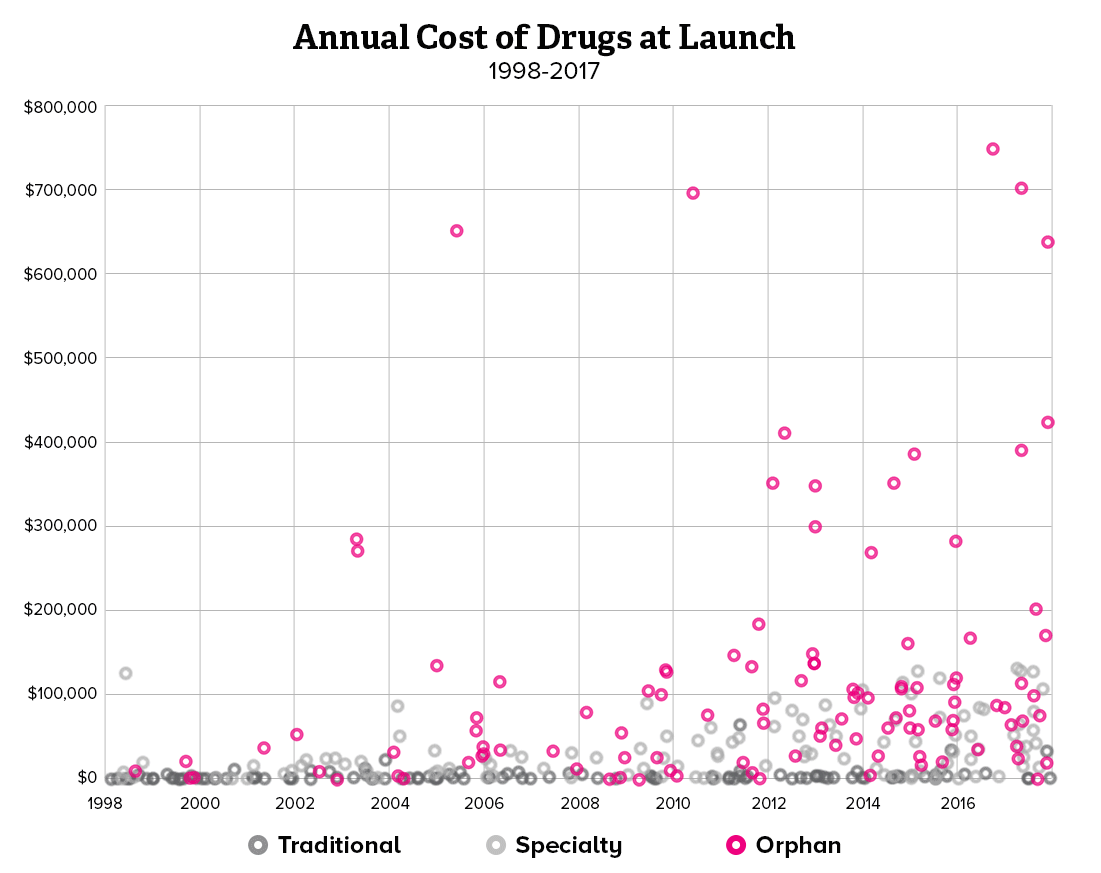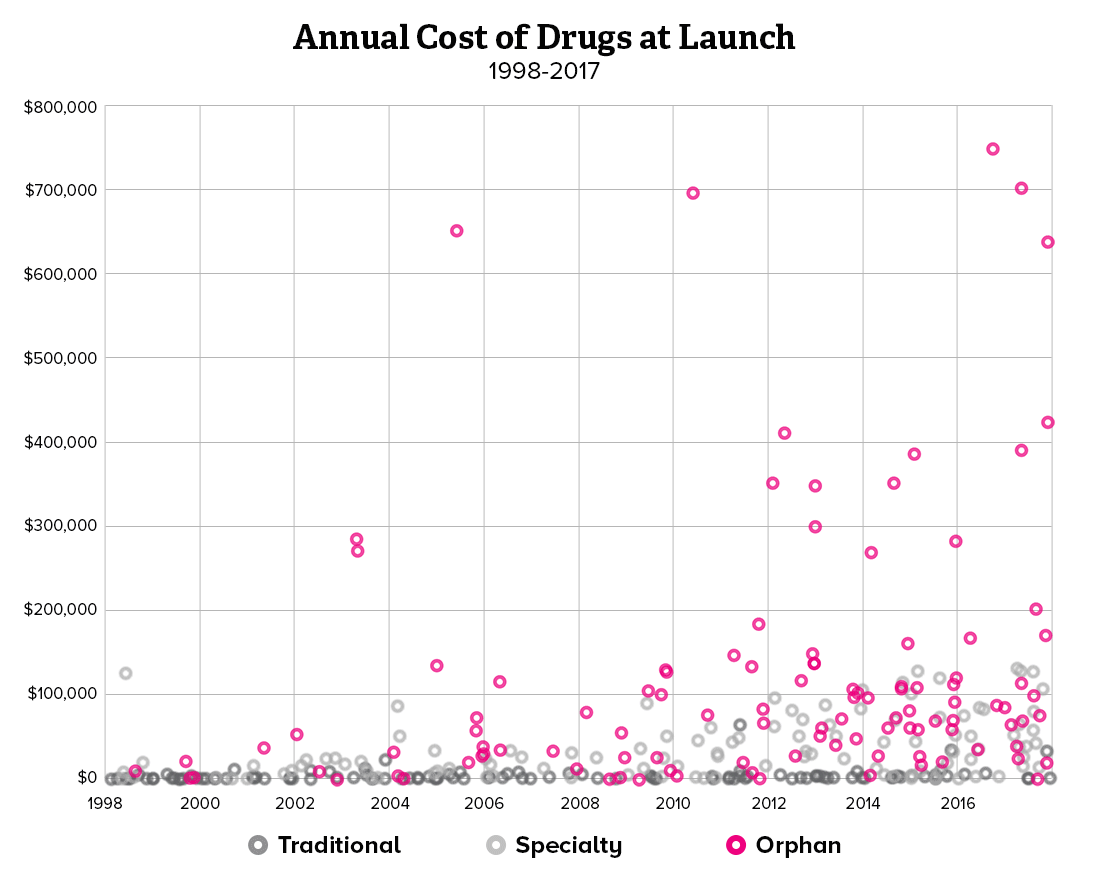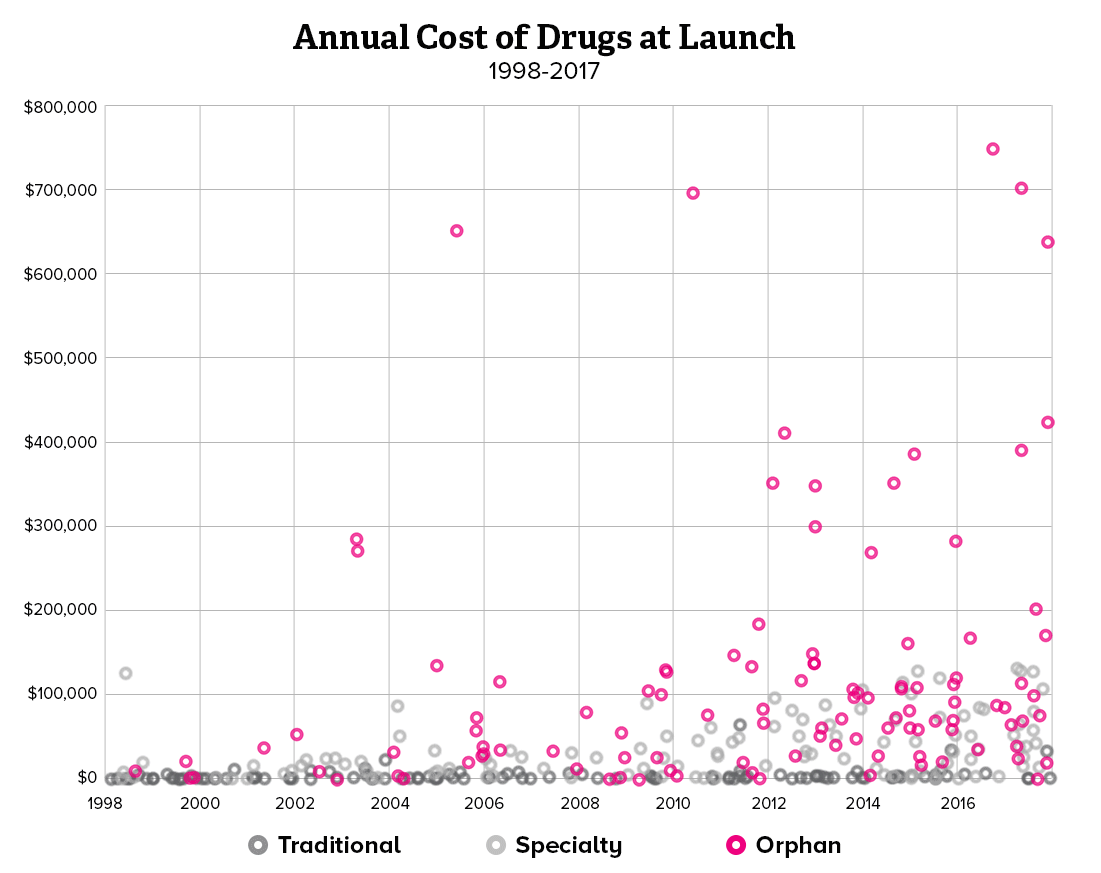
희귀질환 치료제가 처방되기 위해서는 유전적인 원인 규명이 무엇보다 중요하기 때문에, 제약사와 진단사 간의 협력이 강화되고 있습니다. 유전자 진단 회사와 제약사가 제휴를 선언하거나 제약사가 진단사를 인수하는 사례도 생기고 있습니다. 희귀질환 분야에서 주목할 만한 제약사와 진단사 간의 협력 방안과 중요성을 소개해보려 합니다.
희귀질환 환자 발굴
희귀질환 치료제를 개발하는 제약사들의 주요한 과제는 치료에 적합한 환자를 찾는 것입니다. 에브리라이프재단의 조사에 따르면 희귀질환이 의심되는 환자는 진단 방랑을 거치며 진단을 받기까지 평균 6.3년 간 16.9명의 의사를 거치게 됩니다.

조기 진단이 된다면 환자들은 더 빠르게 적절한 치료를 받을 수 있고 제약사들은 더 많은 치료제를 판매할 수 있습니다. 희귀질환 원인의 80%가 유전적 원인을 가지기 때문에 제약사는 유전자 진단 업체와 협력하여 더 많은 희귀 유전자 질환 검사를 진행하고 있습니다.
가장 일반적인 협업 방식은 제약사가 환자에게 유전자 검사 비용을 지원하고 진단사가 검사 서비스를 제공하는 방식입니다. 희귀질환 단체들 또한 이 제휴에 참여해 유전자 검사를 적극적으로 추진합니다.
예를 들면 아래와 같은 사례가 있습니다.
- 선천성 호중구감소증 진단을 위한 X4 제약사와 Invitae의 협력
- 인도에서 LSD 진단을 위한 Takeda 그룹의 Baxalata와 PerkinElmer의 협력
- 뇌성마비 진단을 위한 PTC Therapics와 Invitate의 협력
- 피부 희귀질환 진단을 위한 Krystal Biotech와 GeneDx의 협력
협업을 통해 제약사는 환자를 조기에 발굴하고 치료제를 빠르게 판매함으로써 높은 수익을 기대할 수 있으며, 진단 회사는 검사 서비스 비용을 지원 받아 환자로부터 유전체 데이터를 수집할 수 있습니다. 제약사와 진단사가 supply-chain을 공유하기 때문에 판매와 마케팅 측면에서 시너지 효과가 가능합니다. 비교적 작은 투자로 큰 효과를 볼 수 있기 때문에 이러한 유형의 협업이 초기 단계에는 가장 효과적이라고 할 수 있습니다.
동반진단, Companion Diagnostics(CDx)
FDA는 동반진단(CDx)를 특정 치료에 가장 효과적인 환자 또는 부작용 위험이 높은 환자를 식별할 수 있는 장치로 정의합니다. 정밀 의학과 개인 맞춤의학의 발달로 CDx는 필요한 환자에게 적절한 치료를 처방하는데 있어 더욱 중요한 역할을 합니다. 1998년 첫 번째 CDx가 승인된 이후 2020년까지 44개의 CDx가 승인되었으며, 이 중 35개가 지난 10년간 승인되었습니다.

FDA는 최근 바이오마커를 포함한 신약 승인 절차를 호의적으로 지지하고 있어 앞으로 더 많은 CDx가 개발될 것으로 예상됩니다.
현재 CDx는 대부분 종양학에 집중되어 있지만 최근 암 이외의 희귀질환에서 CDx의 역할도 주목을 받고 있습니다. 정확한 유전적 원인을 규명하고 진단해야 적절한 치료를 처방할 수 있다는 점에서 희귀질환 치료 분야 또한 정밀의학의 넓은 영역이 될 수 있습니다. 예를 들어, 잘 알려진 희귀질환 중 하나인 낭포성 섬유증(CF)은 2000개 이상의 유전자 돌연변이와 관련이 있습니다. 유전자 검사 기반의 CDx 도입은 특정 치료가 효과적인 일부 CF 환자 집단을 선택할 수 있게 함으로써 치료 효과를 높일 수 있습니다.
CDx 분야에서는 진단사와 제약사 간의 협업을 통해 의약품 개발 비용을 절감하고 승인률을 높일 수 있을 뿐 아니라 시판 이후 그 효과를 보장할 수 있습니다. 또한 의사가 임상 환경에서 적절한 약을 처방할 수 있는 기반을 제공할 수 있기 때문에 규제 기관, 제약사, 진단사 및 의료 제공업체 모두에게 이익이 되는 협업 접근법이라고 할 수 있습니다.
의약품 개발
신약 개발에서 시장 승인까지의 과정은 매우 복잡하고 비용이 많이 듭니다. 평균 12년에서 15년, 약 10억 달러가 소요되는 것으로 알려져 있으나 성공률은 10%에 불과합니다. 그러나 제약사와 진단사가 공동으로 신약을 개발하면 비용을 절감하고 승인 기간을 단축할 수 있습니다. 유전적인 지원을 받는 약물 표적이 승인될 확률이 두 배 이상 높다는 연구 결과도 있습니다. 표적발견, 임상환자 모집, FDA 승인 등 의약품 개발 과정에서 다양한 분야의 협업이 가능합니다.
사람의 유전자 발현은 신약 개발에 결정적인 역할을 합니다. 희귀질환 환자의 유전체 정보는 중요한 표현형 정보를 포함하고 있기 때문에 신약 개발에 매우 중요한 통찰력을 제공합니다. 진단사에게 있어 여러 활용을 위해 유전자 정보를 충분히 축적하는 것은 매우 중요하지만 이는 또한 제약사들의 신약 개발에도 도움이 될 수 있기에 제약사와 진단사 모두에게 큰 장기적 가치를 창출할 수 있는 협업 방식이라고도 볼 수 있습니다.
결론
유전자 진단 회사와 제약사의 협업 방식은 진단사의 환자 발견을 위한 보조 역할에서 데이터 분석을 통해 약물 개발에 대한 통찰력을 제공하는 선도 역할로 발전하고 있습니다. 많은 데이터 분석 기술을 보유한 진단 회사는 제약사와 더 다양한 방식으로 제휴를 맺을 수 있을 것입니다.
제약사 또한 유전체 데이터의 가치를 인지하고 데이터 확보에 적극 나서고 있습니다. 진단사의 인수 합병과 함께 유전자 데이터 수집을 위한 국가 차원의 대규모 자금 조달이 이루어지고 있는 모습을 보이며, 그 예로 Amgen, AstraZeneca, GSK, Johnson & Johnson은 12만 5000명의 유전자 정보에 우선 접근하기 위해 영국 바이오뱅크 프로젝트에 1억 2400만 달러를 투자한 점을 들 수 있습니다.
이와 같이, 제약사나 진단사 뿐 아니라 희귀질환 환자 또한 사회적 비용을 절감하는 다양한 협력 방안을 통해 조기 진단과 치료제 혜택을 제공 받을 수 있습니다. 한편, 제약사나 진단사의 이해관게에 따른 진단 신뢰성, 데이터 소유권, 프라이버시, 윤리적 문제에 대한 이익 분배 등 사회 공동체가 함께 풀어야 할 과제가 남아 있습니다. 기업은 각 그룹의 이익을 대변하는 활동 뿐 아니라 사회 전체의 의구심과 우려를 해소하는 활동에도 협력할 필요가 있습니다.
레퍼런스
- FDA. Rare Disease Day 2021: FDA Shows Sustained Support of Rare Disease Product Development During the Public Health Emergency
- AHIP. How Big Pharma Makes Big Profits on Orphan Drugs
- EverlyLife foundation. The National Economic Burden of Rare Disease Study
- Invitae. PATH4WARD
- BioSpectrum. Takeda India brings diagnostic program in support of rare diseases
- Genome Medical. PTC PINPOINT DIRECT
- GeneDx. Krystal Decode DEB
- FDA. Companion Diagnostics
- Jørgensen JT. The current landscape of the FDA approved companion diagnostics. Transl Oncol. 2021;14(6):101063. doi:10.1016/j.tranon.2021.101063
- FDA. Biomarkers at FDA
- Labcorp Drug Development Blog. Can we Expand Companion Diagnostics Beyond Oncology?
- Technology Networks. How Drug-Diagnostic Co-development is Shaping Discovery Research and Pharmacotherapy
- Nelson, M., et al. The support of human genetic evidence for approved drug indications. Nat Genet 47, 856–860 (2015). https://doi.org/10.1038/ng.3314
- Forbes. 23andMe Gets $300 Million Boost From GlaxoSmithKline To Develop New Drugs
- 23andMe Blog. 23andMe and GSK Begin First Clinical Trial with Cancer Therapy
- BioPharma. Pharma takes interest in genomics to next level





















